식약처에서 나온 의료기기
허가 ‧심사 첨부자료 가이드라인(민원인 안내서)에서 친절하게 예시가 있다!
[출처] 식약처
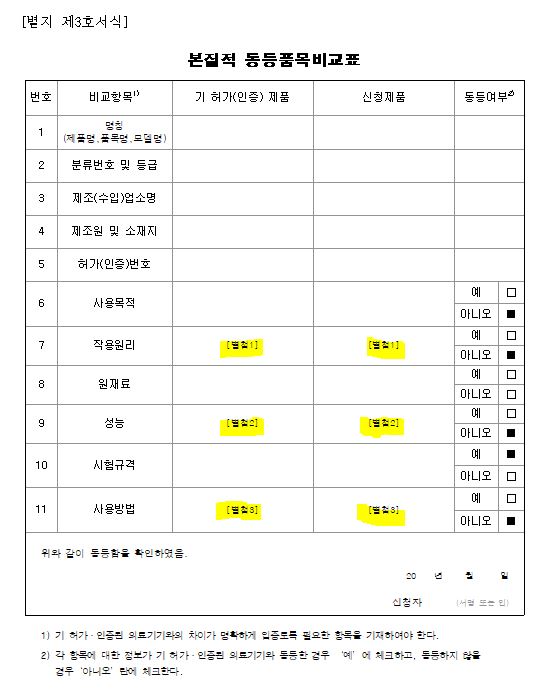
1. 품목명(분류번호 및 등급)
2. 제품명(모델명)
3. 제조(수입)업소명
4. 제조원 및 소재지
5. 허가번호
1-5까지는 쉽게 작성할 수 있을 것 같음.
6. 사용목적 / 7. 작용원리
사용목적, 작용원리 같으면 예! 아니면 아니오~
6번은 품목명에 따른 사용목적을 따라가고
7번은 작용원리는 제품에 해당되는 원리를 기재할 것. 주로 비슷한 제품이 있으면 어느정도는 이용해서 작성.
업체 제품에 따라서 조금씩 다른내용은 수정할 것


8. 원재료
- > 타이타늄-6알루미늄-4바나륨합금 동일하므로 예
9. 성능
- > “골접합용나사”의 경우 기 허가 제품의 성능에 대한 정보가 다르기 때문에 아니오
10. 시험규격
- > 안전성(생물학적 안전에 관한 공통 기준규격) 같으므로 예!
11. 사용방법
- > 제품은 타제품이지만 사용하는방법이 다르므로 아니오!
- 기 허가된 의료기기와의 차이가 명확하게 입증도록 필요한 항목을 기재하여야 한다. -> 확인
- 기재해야 될 내용이 많은 경우 각 항에 “별첨”으로 기재하고, 첨부문서를 작성하여 제출한다.
-> 아래 예시 참고

본질적동등품목비교표

- 각 항목에 대한 정보가 기 허가된 의료기기와 동등한 경우 ‘예’에 체크하고, 동등하지 않을 경우 ‘아니오’란에 체크한다.
- 예시로 제시한 “골접합용나사"의 경우에는 사용목적, 작용원리가 같고 원재료 같고
시험규격은 같으나 사용방법, 성능이 다르기 때문에 개량제품이다!
-> 사용방법, 성능사항이 다르기 때문에 아니오!가 되는데 이때는 알아야할 것
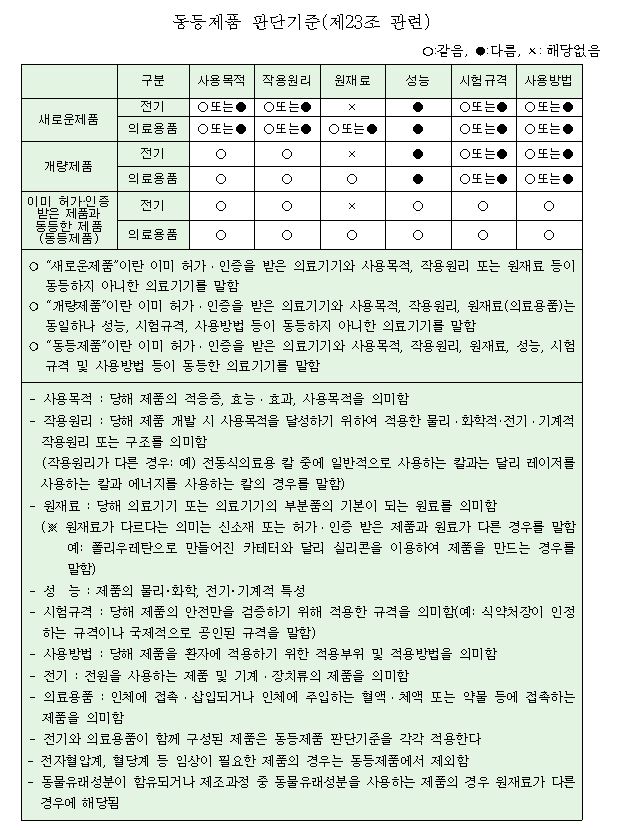
개량제품의 뜻도 알아두자! 즉 사용목적, 작용원리, 원재료(전기제품은 해당없음 의료용품만 해당)는 같은데
성능, 시험규격, 사용방법이 동등하지 않은걸 말함.
※ “개량제품”
이미 허가를 받은 의료기기와 사용목적, 작용원리, 원재료는 동등하나
성능, 시험규격, 사용방법 등이 동등하지 아니한 의료기기를 말한다.
※ 당해 신청제품의 의료기기는 이미 허가를 받은 의료기기와 사용목적, 작용원리, 시험규격, 사용방법은 동등하지만, 성능이 동등하지 않으므로 아래의 자료 제출 범위에 따른다.

'의료기기 허가·심사 첨부자료 > 기 허가 제품과 비교한 자료' 카테고리의 다른 글
| 본질적 동등품목비교표 예시 (10) 의료용품(골접합용판) - 개량제품 (0) | 2020.03.12 |
|---|---|
| 본질적 동등품목비교표 예시 (9) 의료용품(골접합용스태플) - 새로운제품 (0) | 2020.03.12 |
| 본질적 동등품목비교표 예시 (7) 의료용품(골시멘트) - 새로운제품 (0) | 2020.03.12 |
| 본질적 동등품목비교표 예시 (6) 의료용품(골수내고정막대) - 개량제품 (0) | 2020.03.12 |
| 본질적 동등품목비교표 예시 (5) 의료용품(고형이식의료용실리콘재료) - 개량제품 (0) | 2020.03.12 |