4.1.1 가. 조직은 이 기준 요구사항과 적용되는 법적 요구사항에 따라 품질경영시스템을 문서화하여야 하며 품질경영시스템의 효과성을 유지하여야 한다.
나. 조직은 이 기준 요구사항과 적용되는 법적 요구사항에 의해 문서화되어야 하는 특정 요구사항, 절차, 활동 또는 방식을 수립, 실행 및 유지하여야 한다.
다. 조직은 적용되는 법적 요구사항에 따라 조직이 수행하여야 하는 역할에 대해 문서화하여야 한다.
▶ 제조업자는 ISO 13485 요구사항 뿐만아니라 적용되는 법적 요구사항을 추가하여
품질경영시스템을 문서화하도록 신설된 요구사항이다. 또한 요구사항에 의해 문서화되어야 하는 특정 요구
사항, 절차, 활동 또는 체계를 수립, 실행 및 유지하도록 명확화하였다.
요구사항이 문서화해야 한다는 요구가 있을 때, 그것이 수립되고 실행, 유지할 것을 요구하는 것이기도 함.
품질경영시스템 목적 중 하나는 다양한 관할구역의 규제 요구사항을 모아, 단일 시스템으로 접근하는 방식
적용되는 법적 요구사항은 해당 제조소(제조의뢰자 및 제조자)에서 생산 유통하는 모든 국가의
법적 요구사항을 의미하는 것으로 판단된다.
적용되는 법적 요구사항의 예시
(1) 미국 품질시스템 규정
(2) 캐나다 의료기기 규정
(3) 유럽 의료기기 지침/규정
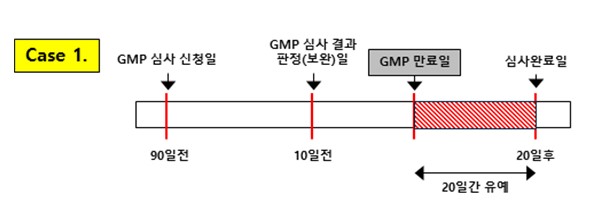
의료기기 제조 및 품질관리 기준(GMP) 심사는 한국의 의료기기 법령의 요구사항으로 한정하여 적용한다.
'조직이 수행해야 할 역할에 대해서 정의하고 문서화해야 한다'
▶ 조직의 중요한 측면은 의료기기 생애주기 또는 제품 및 규제 요구사항의 맥락에서 수행되어야 할 역할에 대하여 정의하고 문서화해야한다.
의료기기 제조 및 품질관리 기준(GMP) 심사
의료기기 제조 및 품질관리 기준 3조 적용범위에 해당하는 자로 적용한다.
ISO 13485(2016) 규격의 요구사항은 제품을 제공하는 공급자 또는 기타 외부 당사자가 사용할 수도
있도록 규정 ISO 13485:2016 개요- 0.1 일반
원자재, 구성요소, 서브어셈블리, 의료기기, 멸균서비스, 검교정서비스, 유통서비스, 유지보수 서비스
▶ 조직의 역할 예시
|
(1) 제조업자
(2) 수입업자
(3) 유통업자
(4) 원자재, 부품, 반제품 공급자
|
(5) 포장, 멸균, 유통서비스 제공
(6) 측정 기기의 교정 서비스 제공자
(7) 개발자
(8) 법적 대리인
(9)계약된 제조업자
|
 의료기기 GMP
의료기기 GMP