혁신의료기기 기술 및 관리기준 표준화에 관한 규정 (식약처 고시 제2020-46호, `20.5.29)
○ 주요내용
1. 혁신의료기기 표준 대상, 제·개정 계획 등 매년 표준 계획 수립
2. 혁신의료기기 기술 및 관리기준 둥 표술 기술 자문
3. 혁신의료기기 표준 제·개정 의견 청취 등
4. 혁신의료기기 표준 신청 및 표준화 검토 기준, 절차 등
혁신의료기기 기술 및 관리기준 표준화에 관한 규정 제정고시
1. 제정이유 : 「의료기기산업 육성 및 혁신의료기기 지원법」 제29조에 따라 혁신의료기기 기술 및 관리기준에 관한 표준의 제정‧개정‧폐지 및 보급 등에 필요한 세부사항을 정하려는 것임
2. 주요내용
가. 혁신의료기기 계획 수립(안 제2조) .혁신의료기기 표준 대상, 제‧개정 계획 등에 대해 매년 표준 계획 수립에 관한 사항을 규정함
나. 혁신의료기기 표준 기술자문(안 제3조) 의료기기위원회, 체외진단의료기기 전문가위원회 또는 외부 전문가를 활용한 기술 및 관리기준 등 표준 기술자문에 관한 사항을 규정함
다. 혁신의료기기 표준 제‧개정 의견청취 등(안 제4조) 혁신의료기기 표준 제‧개정‧폐지하여 보급하는 경우 이해관계인의 의견청취 및 제조허가 등에 활용하도록 규정함
라. 혁신의료기기 표준 신청 및 마련절차 등(안 제5조) 혁신의료기기 표준 신청과 표준화 검토 기준, 절차 등에 관한 사항을 규정 함
제1조(목적)
이 규정은 「의료기기산업 육성 및 혁신의료기기 지원법」 제29조제2항 및 같은 법 시행규칙 제18조에 따른
혁신의료기기 기술 및 관리기준에 관한 표준의 제정ㆍ개정ㆍ폐지 및 보급 등에 필요한 세부사항을 규정함을 목적
제2조(표준 계획 수립 등)
식품의약품안전처장(이하 “식약처장”이라 한다)은 매년 다음 각 호의 사항이 포함된 계획을 수립할 수 있다.
1. 혁신의료기기 표준화 대상
2. 혁신의료기기 표준 제ㆍ개정 계획
3. 혁신의료기기 기술 및 관리기준 조사ㆍ연구ㆍ개발에 관한 사항
4. 그 밖에 혁신의료기기 기술 및 관리기준 표준에 필요한 사항
제3조(표준 기술자문)
식약처장은 혁신의료기기 기술 및 관리기준 표준과 관련된 사항에 대하여 자문이 필요한 경우에는 「의료기기법」 제5조에 따른 의료기기 위원회, 「체외진단의료기기법」 제21조에 따른 체외진단의료기기 전문가위원회 또는 관련 분야 학회 등 외부전문가에게 의견을 청취할 수 있다.
제4조(표준 제ㆍ개정 의견청취 등)
① 식약처장은 혁신의료기기 표준을 제ㆍ개정‧폐지 및 보급하는 경우에는 「의료기기법」 및 「체외진단의료기기법」에 따른 제조업자 등 이해관계인의 의견을 청취할 수 있다.
② 식약처장은 혁신의료기기 표준을 보급하기 위하여 「의료기기법」 및 「체외진단의료기기법」에 따른 제조허가 등에 활용할 수 있다.
제5조(표준 신청 및 마련절차 등)
① 식약처장은 이해관계인 등의 신청이 있는 경우에는 제3조에 따라 자문을 거쳐 표준 계획에 반영할 수 있다.
② 표준 계획에 반영하여 표준화를 하는 때에는 다음 기준에 의한 타당성을 검토하여야 한다.
1. 국내ㆍ외 최초 기술 적용에 따른 표준 필요 여부
2. 기존기술 개선ㆍ개량에 따른 표준 필요 여부
③ 표준 마련을 신청하고자 하는 자는 별지 제1호서식의 신청서를 작성하여 식약처장에게 제출하여야 한다.
④ 제3항에 따라 신청을 받은 식약처장은 표준 마련 등에 대한 타당성을 검토하고 그 처리결과를 90일 이내에 신청인에게 통지하여야 한다.
제6조(재검토 기한)
식약처장은 「훈령ㆍ예규 등의 발령 및 관리에 관한 규정」(대통령훈령 제248호)에 따라 이 규정에 대하여 2020년 7월 1일을 기준으로 매 3년이 되는 시점(매 3년째의 12월 31일까지를 말한다)마다 그 타당성을 검토하여 개선 등의 조치를 하여야 한다.
'의료기기 가이드라인 :) > 혁신의료기기' 카테고리의 다른 글
| 의료기기소프트웨어제조기업 인증제도 운영에 관한 규정 (2020.05.29) (0) | 2024.07.17 |
|---|---|
| 혁신 의료기기 지정 절차 및 방법 등에 관한 규정 (2020.05.29) (0) | 2024.07.17 |
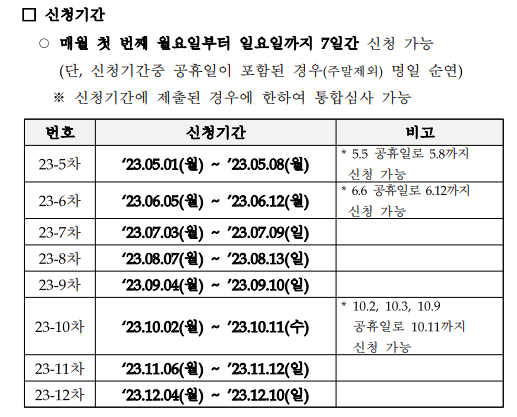
| [식품의약품안전처] (10차, 10.11까지) 혁신의료기기 지정 통합심사 공고 안내 (0) | 2023.10.06 |